逆转录病毒介导高效的白血病细胞基因转移
中华肿瘤杂志 1998年第3期第0卷 基础研究
作者:傅建新 陈子兴 岑建农 王玮 阮长耿
关键词: 白血病 逆转录病毒 基因转移 基因治疗 转染 聚合酶链反应
【摘要】 目的 建立安全高效的逆转录病毒介导的基因转移系统,为白血病基因治疗提供实验基础。方法 分别用脂质体转染和小鼠逆转录病毒转导方法,将含标志基因NeoR的逆转录病毒载体pLXSN导入双嗜型包装细胞GP+envAm12,获得重组逆转录病毒;用含病毒上清感染白血病细胞系(NB4、U937和THP-1),并分析对K562细胞的转导效率。结果 脂质体DOSPER转染法获得病毒滴度为8.0×105 cFU/ml,而病毒感染法高达1.6×107 CFU/ml。经G418选择,PCR证实NeoR基因被整合到白血病细胞基因组中,巢式PCR与补救分析均未检测到辅助病毒存在。单个集落K562细胞的PCR分析证实,基因转移效率可达93.3%~100%。结论 逆转录病毒介导的基因转移系统是高效、安全的,有助于人类白血病的基因治疗研究。
Efficient gene transfer mediated by retrovirus vector in leukemic cells Fu jianxin, Chen Zixing, Cen Jiannong, et al. Jiangsu Insitute of Hematology, First affiliated Hospital of Suzhou Medical College, Suzhou215006
【Abstract】 Objective To establish an efficient and safe gene transfer system mediated by retrovirus for providing an experimental basis of gene therapy in human leukemia.Methods The retrovirus vector pLXSN, carrying the NeoR, was transferred into amphotropic packaging cell line GP+envAm12 by liposome method or by transduction. retrovirus with higher titer was used to infect human leukemic cell lines NB4, u937 and THP-1. The efficieney of gene transduction was tesed on colonies formed by K562 cells after gene transduction.Results The titer of DOSPER liposome transfected GP+envAm12 pool on NIH3T3 cells was 8.0×105CFU/ml while that of producer pool infected with mouse retrovirus was 1.6×107 cFU/ml. Integration of NeoR into human leukemic cells was confirmed by PCR. By both nested PCR and NeoR rescue assay, no helper virus was found. NeoR gene transfer with the efficiency as high as 93.3 to 100% in K562 cells was verified by semi-nested PCR on the colonies after seven days' culture.Conclusion The efficiency and safety of the gene transfer system may provide an optimal experimental system in gene therapy for human leukemia.
【Subject words】 Leukemia Retrovirus Gene transfer Gene therapy Transfection Polymerase chain reaction
基因转移是遗传性疾病或肿瘤基因治疗的分子基础。利用逆转录病毒载体介导将外源性基因导入细胞和动物是目前基因转移的首选方法,并已被多数临床试验方案采用[1]。我们应用逆转录病毒载体pLXSN,将新霉素耐药基因(NeoR)导入白血病细胞,以研究对白血病进行基因治疗的可行性。
材料与方法
1.细胞系与病毒载体:人类白血病细胞系(NB4、U937、THP-1与K562)、小鼠逆转录病毒生产细胞GP+E86/NeoR(滴度为8.1×106 cFU/ml)及NIH3T3均由本实验室保存,双嗜型包装细胞系GP+envAm12由美国哥伦比亚大学医学院Bank博士提供,含标志基因NeoR的逆转录病毒载体pLXSN(图1)由美国NCI的 cowan博士惠赠。

图1 逆转录病毒载体pLXSN结构示意图
2.脂质体介导质粒转染:参照供应商所推荐的方法,用脂质体DOSPER(Boehringer mannheim公司)将pLXSN质粒导入包装细胞中,以0.8 g/L G418(GIBCO/BRL公司)筛选并获得病毒生产细胞阳性克隆。以NIH3T3为受体细胞常规测定病毒滴度。
3. 小鼠病毒感染双嗜型包装细胞:将含8 mg/L聚凝胺(Sigma公司)的GP+E86/NeoR细胞上清加入GP+envAm12细胞,37℃2小时;换液2次后加入DMEM使聚凝胺降至2 mg/L,继续培养24小时后以0.8 g/L G418选择,获得双嗜型逆转录病毒生产细胞。
4.感染白血病细胞:用双嗜型病毒上清感染白血病细胞系NB4、U937和THP-1,37℃2小时后即换成新鲜RPMI 1640,用G418选择培养。对感染的K562细胞做半固体培养,以检测基因转移效率。
5. K562细胞CFU-L分析:感染的K562细胞于37℃继续培养24小时,按100个细胞培养皿(直径35 mm)在含1%甲基纤维素(Fisher scientific公司)与20%胎牛血清的RPMI1640中进行半固体集落培养。7~10天后,用微量吸管吸取分离良好的单个集落分析基因转移效率。
6. PCR检测NeoR基因:以快速法制备的3种转导细胞或单集落K562细胞的基因组DNA为模板,用PCR检测NeoR基因的整合状况。引物序列Neo1:5′-CGT tGT CAC TGA AGC GGG AAG G-3′,Neo2:5′-CCA TGA TAT TCG gCA AGC AGG C-3′,Neo3:5′-CAA gAT GGA TTG CAC GCA- GG-3′(均由上海Sangon公司合成)。转导细胞采用引物对Neo1~2;单集落细胞则采用半筑巢式PCR,即先后用Neo3~2引物对与Neo 1~2引物对扩增。PCR反应参数为:95℃30秒,63℃ 45秒,共30个循环。
7. 筑巢式PCR检测辅助病毒env基因:双嗜型包装细胞内小鼠白血病病毒4070A的env基因PCR引物由复旦大学遗传学研究所卢大儒博士提供[2]。
8. 补救分析检测辅助病毒:用3T3放大分析检测功能性辅助病毒。将含双嗜型逆转录病毒上清感染NIH3T3细胞,G418选择并传代3次,再用其上清感染NIH3T3细胞,培养48小时后以1∶20传代至含0.8 g/L G418的培养基,继续选择培养2周,观察有无克隆形成。
结果
1.病毒生产细胞的鉴定:经DOSPER介导将pLXSN质粒转染双嗜型包装细胞GP+envAm12,以G418筛选得到多个抗性克隆。以NIH3T3为受体细胞,测得其混合上清中重组病毒滴度为8.0×105 cFU/ml。将具有不同宿主范围ENV的包装细胞GP+envAm12与GP+E86交互感染,发现双嗜型病毒滴度可被提高到1.6×107 cFU/ml。故此“乒乓效应”可显著提高病毒滴度。此外,PCR证实,NeoR基因已整合到包装细胞GP+envAm12基因组。
2.逆转录病毒介导标志基因转移:用滴度为1.6×107CFU/ml的双嗜型病毒感染NB4、U937与THP-1细胞,筛选并获得NB4/NeoR,U937/NeoR与THP-1/NeoR。PCR证实,3种经转导的细胞均可扩增出NeoR基因特异的347bp片断,提示NeoR基因已成功整合至白血病细胞DNA,完成基因标记。
3.基因转导效率分析:在无造血生长因子的条件下,以K562细胞为模型,通过半筑巢式PCR分析单个CFU-L的NeoR基因整合状况,研究逆转录病毒载体介导的基因转移效率。分3次吸取共35个集落细胞,经PCR分析,显示基因转导效率为93.3%~100%,表明本基因转移系统具有高效性。
4.辅助病毒的检测:在逆转录病毒介导的基因转移中,靶细胞被复制缺陷型病毒感染后应无病毒反式结构基因整合。辅助病毒的筑巢式PCR检测结果如图2所示,3种转导细胞除出现内对照MDR-1的830bp产物外,均未能扩增出env基因,而作为对照的GP+envAm12则出现224bp的阳性条带,表明本基因转移体系中无辅助病毒产生。在补救分析实验中,重组的复制缺陷型病毒仅能将NeoR基因转移至NIH3T3细胞,后者因无病毒反式结构基因的补救而不能再将NeoR基因转移至NIH3T3受体细胞,经G418选择后均未见有抗性克隆生长,从功能上证实无辅助病毒的产生,表明该基因转移系统是较为安全的。
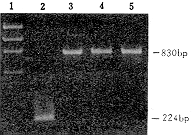
1:X174 rF DNA/HaeIII分子量标准;2:GP+envAm12细胞;3:NB4/NeoR细胞;4:U937/NeoR细胞;5:THP-1/NeoR细胞
图2 筑巢式PCR扩增辅助病毒env基因
讨论
以CD34+造血干/祖细胞或白血病细胞为靶细胞的基因治疗,目前已有多项方案进入临床试验,并显示其广阔的应用前景。尽管高水平的野生型辅助病毒(或称可复制逆转录病毒,RCR)未能在非人灵长类动物引起疾患,但也有人发现RCR可在免疫受抑猴体内引发T细胞淋巴瘤,故须将产生RCR的可能性降至最低。基因转移系统的安全性可从载体与包装细胞两方面进行改进。pLXSN载体的骨架为Moloney小鼠白血病病毒(MoMLV),其序列与病毒反式结构基因的同源性很小,且载体的gag基因起始密码子被定点诱变为终止密码子,并将env基因从载体上切除;而所用包装细胞中起反式互补作用的gag-pol基因与env基因分别位于两个质粒上,并均缺失ψ包装信号与3′LTR,需3次以上独立重组才能形成完整的病毒基因组,因而其产生RCR可能性极低。我们采用灵敏的筑巢式PCR与补救分析均未发现有RCR产生,证明本系统是较为安全的。此外,GP+env am12细胞比病毒结构基因位于同一载体的PA317细胞更为安全[3,4]。需要指出的是,筑巢式PCR即使检测到env基因,在GP+envAm12介导的基因转移系统中并不肯定有RCR产生,只有当所有反式互补基因均存在才足以产生RCR。
尽管逆转录病毒载体可有效地介导基因向多种靶细胞转移,重组逆转录病毒滴度较低仍是该系统的主要不足,故提高滴度仍是目前研究的重要课题。新近研究发现,丁酸钠可通过活化MoMLV的 lTR而提高病毒的滴度,且地塞米松有增强作用[5]。通过将PA317与GP+E86细胞共培养的“乒乓效应”来提高重组病毒滴度,简便、有效,甚至可高达1010CFU/ml[4]。在本研究中,以更为安全的GP+E86/NeoR转导GP+envAm12细胞,比脂质体转染法获取的病毒滴度提高20倍,且未发现有RCR产生,其方法更为简便。因此,利用“乒乓效应”来提高病毒的滴度是安全、有效、可行的,并在K562细胞中得到很高的转导率,为进行白血病的基因治疗或基因标记奠定了基础。除白血病细胞外,造血干/祖细胞在造血生长因子的作用下也可取得高达93%的转导率[6],也证实逆转录病毒载体介导基因转移的高效性。
NeoR基因是目前常用的标志与体外选择性基因。Dunbar等[7]用NeoR基因标记证实,经动员的外周血干细胞参与自体移植后的长期植活;Nolta等[8]以此为手段亦对早期造血细胞进行基因转导的条件进行了研究。本研究获得的高滴度病毒生产细胞可用于白血病细胞与造血干细胞的基因标记,同时为对不同靶细胞进行高效基因转导的实验研究提供有效的手段,并为将来白血病基因治疗奠定了基础。
本课题受国防科技科研项目(55.7.3.1.01-1)资助,部分受国家自然科学基金(39770306)及江苏省卫生厅科研项目(H9549)资助
参考文献
1Anderson WF. human gene marker/therapy clinical protocols. Hum Gene Ther, 1995, 4:129-130.
2卢大儒, 邱晓云,郑冰, 等.基因治疗研究中有复制能力逆转录病毒的检测.病毒学报,1996, 12: 135-141.
3Markowitz D, Goff S, Bank A. Construction and use of a safe and efficient amphotropic packaging cell line. Virology, 1988, 167:400-406.
4Lynch CM, Miller AD. Production of high-titer helper virus-free retroviral vectors by cocultivation of packaging cells with different host ranges. J Virol,1991, 65:3887-3890.
5Pages JC, Loux N, Farge D, et al. Activation of Moloney murine leukemia virus lTR enhances the titer of recombinant retrovirus in ψCRIP packaging cells. Gene Ther, 1995, 2:547-551.
6Bregni M, Magni M, Siena S, et al. Human peripheral blood hematopoietic progenitors are optimal targets of retroviral-mediated gene transfer. Blood,1992,80: 1418-1422.
7Dunbar CE, Cottler-Fox M, O'Shaughnessy JA, et al. Retrovirally marked cD34-enriched peripheral blood and bone marrow cells contribute to long-term engraftment after autologous transplantation. Blood, 1995, 85:3048-3057.
8Nolta JA, Smogorzewska EM, Kohn D. Analysis of optimal conditions for retroviral-mediated transduction of primitive human hematopoietic cells. Blood,1995, 86:101-110.
(收稿:1997-10-07 修回:1997-12-01)