Fas调节白血病细胞HL-60内Stat3的表达和磷酸化
第二军医大学学报2000年第21卷第6期
刘厚奇 单继宽 汤淑萍 刘善荣
摘 要 目的:观察Fas对HL-60细胞的异常增殖是否有调节作用。方法:用基因重组技术将Fas的细胞外区跨膜区与IL-6信号传导子gp130细胞内区构成嵌合型受体(Fas/130),同时,将Fas死亡区域(FasDD)替换Fas/130中130细胞内区无结构域部分(Fas/130f),分别在HL-60中表达后,用抗Fas抗体激活这些嵌合型受体,随后用免疫组化和蛋白质印迹法分析受体细胞内区形成同源性三聚体(130cyt-130cyt-130cyt及FasDD-FasDD-FasDD)后细胞内Stat3的表达及磷酸化。 结果:转染pED fas/130后用抗Fas抗体作用6~8 h,HL-60细胞Stat3表达下降(P<0.05),而Fas/130f组的Stat3的表达下降更明显(P<0.01);两实验组中Fas/130f组在特异性抗体诱导10 min时,Stat3 Tyr705磷酸化较Fas/130组明显降低(P<0.01)。结论:Fas死亡域抑制白血病HL-60细胞内Stat3的表达,并同时抑制Stat3 Tyr705磷酸化。
关键词:细胞因子;受体;白血病;凋亡;信号传导
白血病细胞的异常增殖是影响白细胞正常功能的主要原因。调节这种异常增殖是目前的一大研究热点。白血病抑制因子(LIF)可抑制白血病细胞的增殖[1],其生物效应有赖于其结合靶细胞膜上的LIF受体α亚基(gp190),并使之与另一亚基(gp130)形成异源性二聚体[2],从而使细胞内一系列信号分子发生变化[3]。然而,LIF的作用非常广泛,已被排除在候选治疗药物之外。目前已明确, fas是一个具有受体特性的凋亡因子,它的细胞内区含一个介导死亡信息的结构域(FasDD)[4]。本研究用基因重组技术制备嵌合型受体(Fas/130和 Fas/130f),并分别在HL-60中表达,分析各组细胞内Stat3的表达及磷酸化水平,以确定Fas死亡域对白血病细胞增殖的影响。
1 材料和方法
1.1 细胞株 HL-60细胞株由中科院上海细胞所提供,该细胞株用含8%小牛血清的 dMEM (Gibco)37℃,5% CO2 条件下培养。
1.2 Fas嵌合体的制备 以pRclgo gp130(Moreau博士提供)为模板,分别以SalⅠ/Xho Ⅰ,Xba Ⅰ酶切并装入pALTER。引物为:5′-GTCTCGCTTT cTAGAGCAGAACAGCAC-3′,并用Altered Sites Ⅱ突变系统(Promega)使跨膜区与细胞内区之间产生XbaⅠ酶切位点。同样,pBluescript人 Fas (Taupin 博士惠赠) 用同样方法产生 Xba Ⅰ(引物: 5′- C tTC CTT TCT AGA CAC CCA AAC AA- 3′) 。经Hind Ⅲ和Xba Ⅰ 酶切分离Fas细胞外区和跨膜区并与gp130细胞内区(130cyt)重组为Fas/130。最后以Hind Ⅲ/SalⅠ,EcoR Ⅰ将两嵌合体从pALTER移至表达载体pED(Moreau博士提供)。
1.3 Fas死亡结构域的分离和装配 用PCR扩增Fas死亡域片段,N端(5′-GT AAG GAT CCC ACC ACT ATT GC-3′) 和 C端 (5′-TTC TGG ATC CCT AGT AAT gTC C-3′) 各含一BamH Ⅰ位点。然后 用BglⅡ-BglⅡ去除gp130细胞内区的第66~153氨基酸(88 AA),并用Fas的第 233~320氨基酸取代,即构成含FasDD的嵌合体 fas/130f。
1.4 Fas嵌合体基因的HL-60细胞转染 含各嵌合体基因的反转录病毒载体pED(pED fas/130 和pED Fas/130f)用脂质体转染法(Gibco-BRL公司的LipofectamineTM和操作步骤)分别转染于HL-60,72 h后收集细胞待用。
1.5 免疫组化检测Stat3的表达 转染成功后的细胞用含200 ng/ml抗Fas抗体的新鲜培养基孵育8~12 h,接着用冷冻PBS将细胞洗2次,接着浸入4%甲醛中固定30 min,均匀涂布于覆有铬明矾明胶的载玻片上,37℃过夜。检测前将涂有细胞的载玻片重新固定20 min,然后用PBS洗3次。滴加正常羊血清封闭20 min。兔抗人Stat3 igG(Pharmagene)37℃反应1 h后,用AKP标记羊抗兔IgG(Promega)在同等条件下与细胞孵育。随后浸泡于碱性磷酸酶缓冲液(pH9.5)5 min,并用 BCIP/NBT使之显色。显微镜观察细胞显色适当后,用自来水冲洗、烘干、中性树胶封片。生物显微图像分析系统(复日,FR-988 smartScape2000)摄像、标记、分析。
1.6 免疫组化检测Stat3的磷酸化 转染细胞用无血清培养基培养24 h后,与抗Fas 抗体反应0~30 min,并立即用4%甲醛固定。一抗为兔抗人磷酸化Stat3(Tyr705)。其余条件同上。
1.7 蛋白质印迹分析Stat3的表达 用冷冻PBS将细胞洗2次,然后按5×106个细胞加100μl TBS(pH 7.4, 20 mmol/L Tris-HCl,150 mmol/L NaCl,1 mmol/L EDTA),含1% triton X-100 200 μmol/L ,PMSF(Sigma) 2 μmol/L ,Leupeptin 2 μmol/L aprotinine(华顺试剂公司)。在冰上反应20 min后,4℃离心 12 000 r/min 20 min。上清走12% SDS-PAGE凝胶电泳,用槽式转膜仪(TE52X pharmacia Biotech)将蛋白转移到PVDF(Whatman)。兔抗人Stat3 IgG与膜蛋白结合,AKP标记的抗兔IgG与一抗结合,BCIP/NBT作为酶底物显色。
2 结 果
2.1 Fas嵌合体的制备 用Altered Sites Ⅱ突变系统按设计在gp130的跨膜区和细胞内区间产生的限制性内切酶位点经XbaⅠ酶切证实,gp130细胞内区Fas的细胞外区跨膜区基因以及FasDD的扩增序列用全自动DNA测序仪(ABI pRISM 373A)分析均正确无误。
2.2 Fas嵌合体基因的HL-60细胞转染 用脂质体将pED Fas/130 和pED fas/130f分别转染于HL-60细胞,并证实各嵌合体分别在HL-60细胞中表达[5] 。
2.3 免疫组化检测Stat3的表达 加入200~500 ng/ml 抗人Fas抗体,与Fas/130和Fas/130f中的Fas细胞外区结合而分别形成三聚体,观察各组细胞内Stat3表达水平。结果发现,Stat3表达Fas/130组较对照组为低(P<0.05),而Fas/130f组却较Fas/130更低(P<0.01,图1)。实验证明,130细胞内区形成三聚体时可抑制Stat3的表达,Fas死亡域也有协同作用。另外,我们制备了一190/130f嵌合体[6]作为对照,以确认Fas死亡域在单体时是否有活性。结果发现,190/130f组细胞内的Stat3水平与空白对照组无差别(图2),表明Fas死亡域单体存在于细胞内,并不发挥效应。
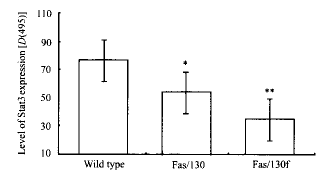
图 1 含嵌合体HL-60内Stat3水平
fig 1 Stat3 expression in HL-60 transfected
with Fas/130 or Fas/130f
P<0.05; P<0.01 vs wild type
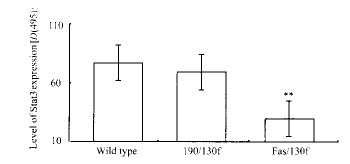
图 2 Fas死亡域单体和寡聚体与Stat3的关系
fig 2 Stat3 level in HL-60 transfected
with 190/130f of Fas/130f P<0.01 vs wild type
2.4 免疫组化分析Stat3磷酸化的变化 抗Fas抗体反应0,5,10,15,20,30 min 后,实验组各时间点的Stat3磷酸化水平均较对照组为低,而Fas/130f组在10 min时Stat3磷酸化水平较Fas/130为低(图3)。实验表明,Fas死亡域对Stat3的磷酸化有影响。
2.5 蛋白质印迹分析Stat3的表达 从图4可以看出, Fas/130组和Fas/130f组的Stat3的表达较对照组低。
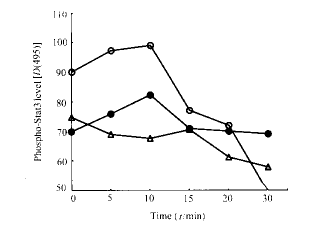
图 3 Fas死亡域对HL-60内Stat3磷酸化的影响
fig 3 Various levels of phospho-Stat3
in the groups○: Wile type ; ●: Fas/130; △: Fas/130f
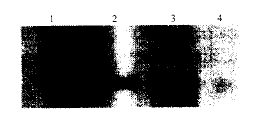
图 4 抗Fas抗体诱导Fas/130和Fas/130f寡聚化后细胞内Stat3的变化
fig 4 Stat3 level in HL-60 transfected with Fas/130
or Fas/130f after anti-Fas IgG induction
1: The group of Fas/130f; 2: The group of Fas/130
3: HL-60 with pED; 4: HL-60 without anti-Fas IgG
3 讨 论
Fas是一具有受体特性的细胞凋亡因子,为319个氨基酸的跨膜糖蛋白。它在淋巴细胞、单核细胞、内皮细胞等表达。Fas配体(Fas l)和抗Fas抗体与Fas细胞外区结合后其细胞内区的蛋白三级结构发生变化,从而细胞内区中的Fas死亡域激活下游分子而促进细胞凋亡[7] 。
TNF 受体家族成员包括Fas都是以三聚体传递信息的[7]。譬如, Fas L[7] 和抗Fas抗体[8]诱导Fas传递死亡信号是以Fas的三聚体形式来体现的。而用G-CSF作用G-CSF/Fas嵌合体后Fas细胞内区形成的二聚体却不能产生效应[9]。本研究设计的嵌合体细胞外区为Fas,允许安插在 gp130细胞内区的Fas 死亡域经抗Fas抗体诱导形成三聚体,分析Fas死亡域与细胞内信号分子的关系。
Fas 诱导细胞凋亡的分子指征有不少,如有人证实Fas的功能包括抑制增殖细胞核心抗原(PCNA)的表达和c-myc的合成[10]。现已明确,如caspases、磷脂酶、已知的3个MAPK途径和 nF-kappa B 等参与了Fas和TNF受体的信号传递[11]。然而,Fas死亡域在细胞凋亡过程中起何作用仍然不明。我们的实验表明,Fas死亡域形成三聚体后,HL-60细胞内的Stat3明显减少(图1),同时,在抗Fas抗体作用10 min时,Fas/130f组的Stat3 Tyr705 的磷酸化较Fas/130组也有所下降(图3)。可以断定,Fas死亡域介导的细胞凋亡信号包含抑制Stat3的表达和抑制Stat3的磷酸化。由于细胞内Stat3的含量下降明显,说明Fas死亡域影响Stat3的生物学活性一定有其他信号分子的介入。
【基金项目】国家自然科学基金资助项目(39670683)
【作者简介】刘厚奇(1957~),男(汉族),副教授,硕士生导师【作者单位】刘厚奇(第二军医大学基础医学部组织胚胎学教研室,上海200433)
单继宽(第二军医大学基础医学部组织胚胎学教研室,上海200433)
汤淑萍(第二军医大学基础医学部组织胚胎学教研室,上海200433)
刘善荣(第二军医大学基础医学部组织胚胎学教研室,上海200433)
参考文献
[1] Metcalf d. The leukemia inhibitory factor[J]. Intern J cell cloning, 1991,9(2):95-108.
[2] Gearing DP, Thut CJ, VandaBos T, et al. Leukemia inhibitory factor receptor is structurally related to the IL-6 signal transducer gp130[J]. eMBO J,1991,10(10):2839-2848.
[3] 刘厚奇,傅继梁.白血病抑制因子受体与细胞内信号分子[J].国外医学*分子生物学分册,1998,20(6):166-169.
[4] Rieux-Laucat F, Le Deist F, Roberts AG, et al. Mutations in Fas associated with human lymphoproliferative syndrome and autoimmunity[J]. science, 1995, 268(5215):1347-1349.
[5] 刘厚奇,单继宽,汤淑萍,等. Fas死亡结构域调节白血病细胞 meg-01 内c-myc的表达[J]. 中华血液学杂志,2000(待发表).
[6] 刘厚奇,汤淑萍,刘善荣,等.白血病抑制因子受体中gp130细胞内区诱导白血病细胞Meg-01内c-myc的表达[J].第二军医大学学报,2000,21(6):522-525.
[7] Tanaka M, Suda T, Takahashi T, et al. Expression of the functional soluble form of human Fas ligand in activated lymphocyte[J]. EMBO J, 1995,14(6): 1129-1135.
[8] Dhein J, Daniel PT, Trauth BC,et al. Induction of apoptosis by monoclonal antibody anti-APO-1 class switch variants independent on cross-linking of APO-1 cell surface antigens[J]. J Immunol, 1992, 149(10):3166-3173.
[9] Takahashi T, Tanaka M, Ogasawara J, et al. Swapping between Fas and granulocyte colony-stimulating factor receptor[J]. J Biol Chem, 1996,271(29): 17555-17560.
[10] Peng X, Maruo T, Matsuo H, et al. Serum deprivation-induced apoptosis in cultured porcine granulosa cells is characterized by increased expression of p53 protein, Fas antigen and Fas ligand and by decreased expression of PCNA[J]. Endocr J,1998, 45(2): 247-253.
[11] Wallach D, Varfolomeev EE, Malinin NL, et al. Tumor necrosis factor receptor and Fas signaling mechanisms[J]. Annu Rev Immunol, 1999, 17:331-346.