糖皮质激素对哮喘豚鼠肺组织IL-5 mRNA表达及嗜酸性粒细胞浸润的影响
第三军医大学学报1999年第21卷第2期
毕玉田 杨肇亨 王长征
提 要 目的:探讨哮喘时嗜酸性粒细胞(Eos)浸润与IL-5 mRNA表达的关系以及糖皮质激素对其影响。方法:采用孵蛋白(OA)吸入致敏制作豚鼠哮喘模型,在诱发哮喘24 h后,检测支气管肺泡灌洗液(BALF)中不同密度的Eos的数量及其百分比,肺组织中原位IL-5 mRNA的表达,以及地塞米松预防用药6 d对其变化的影响。结果:①哮喘组BALF中Eos总数增加,低密度Eos(HEo)增加尤为显著;肺组织中IL-5 mRNA原位表达水平显著增加(P<0.01);②与哮喘组比,地塞米松预防用药后Eos计数及HEo百分比显著减少(P<0.01);③相关分析发现,IL-5 mRNA表达水平与Eos总数(r=0.688,P<0.01)及HEo百分比显著正相关(r=0.582,,P<0.01)。结论:哮喘豚鼠肺组织IL-5 mRNA表达的增加与BALF中Eos数量增多密切相关。抑制IL-5 mRNA表达可能是糖皮质激素减少Eos浸润及治疗支气管哮喘的重要机制之一。
关键词:哮喘 嗜酸性粒细胞 白细胞介素-5 原位杂交 地塞米松
支气管哮喘是一种以嗜酸性粒细胞(Eos)、肥大细胞反应为主的气道慢性炎症[1]。Eos通过释放颗粒蛋白导致上皮损伤,Eos也可产生白三烯、PAF,导致支气管痉挛、粘液分泌增多,从而导致哮喘的发生[2]。IL-5是主要由Th2类淋巴细胞产生的特异作用于Eos的细胞因子,被认为是抑制Eos凋亡的细胞因子[3]。抗IL-5抗体可阻止抗原诱发的哮喘Eos浸润和气道高反应性[4]。糖皮质激素治疗哮喘的重要机制之一即为抑制IL-5的产生[5]。本研究采用卵蛋白吸入诱发豚鼠哮喘模型,分析支气管肺泡灌洗液(BALF)Eos细胞数目改变。检测不同密度Eos数目及比例改变,并采用原位杂交技术检测肺组织IL-5 mRNA表达,以及地塞米松对其表达的影响,为临床治疗哮喘提供新的理论依据。
1 材料和方法
1.1 哮喘动物模型的制作
36只豚鼠(第三军医大学动物所提供),雌雄不限,体重300~400 g,随机分为正常对照组(C组)、哮喘组(A组)、地塞米松治疗组(D组)。A组:参照Hutson方法[6],复制哮喘模型,诱发后24 h采集标本。C组:用生理盐水替代OA致敏,诱发同A组。D组:致敏和诱发同A组,在第16 d用0.5 mg·kg-1.d-1地塞米松腹腔注射。连续6 d,诱发前12 h停药。
1.2 标本采集
实验豚鼠麻醉后,开胸暴露心脏,经左心室→主动脉弓灌注生理盐水约200 ml(至从左心房流出的液体基本清亮为止),同时分离出气管,轻夹右下肺,剪开气管,气管插管,行支气管肺泡灌洗,收集BALF用于分离细胞。松开右下肺,经心脏灌注4%多聚甲醛-PBS缓冲液300 ml,同时向气管内灌注10 ml。灌注固定后30 min取出支气管肺组织,投入相同的固定液置于4℃冰箱继续固定,取部分右下肺修整,按文献[7]制作原位杂交组织切片。
嗜酸细胞的分离:制成密度为1.090 kg/L和1.080 kg/L的Percoll液,各2 ml先后加入15 ml锥形玻璃试管,然后轻轻沿管壁加BALF于其上,2 000 r/min离心20 min,离心完毕后,分别收集第一层、中间层及沉淀细胞,对这三层Eos行绝对计数,中间层及沉淀细胞Eos纯度达95%以上,细胞活力(台盼蓝染色检查)>95%。
1.3 探针的制备及标记
按常规行鼠IL-5 cDNA质粒pSP6K-mTRF23(Akira Tominaga教授惠赠)的转化、扩增、抽提和纯化,BamHI酶切、目的片段回收,片段约1.5 kb。按宝灵曼公司试剂盒说明操作。用地高辛配基随机引物法标记IL-5 cDNA探针。
1.4 原位杂交
参照文献[7]进行,略有改进。阴性对照:肺组织切片预先经RNA酶处理后再行原位杂交。图像分析:每一玻片任选5个视野,自动检测阳性细胞面密度,取其平均值,进行统计分析。
1.5 统计学处理
数据用X±s表示。组间比较及相关分析全部用非配对计量资料检验和直线相关分析。
2 结果
2.1 支气管肺泡灌洗液中Eos分类计数
将从三组实验动物获得的BALF以Percoll处理后,可见细胞按不同比重分为三层,第一层细胞比重≤1.080。第二层细胞比重在1.080~1.090之间(1.080<d≤1.090),第三层细胞比重>1.090。由表1可见,A组在三种密度分层细胞中Eos计数均显著高于C组及D组,特别是在第一层细胞中,C组Eos分布极少,但A组Eos显著增加,达总数的30%。D组较C组各层的细胞数目显著增高,但与A组相比明显减少。
计数第Ⅰ、Ⅱ层Eos总和,定义为低密度Eos(HEo,d≤1.090),而比重大于1.090的Eos定义为正常密度的Eos(NEo)。结果表明,A组BALF中Eos总数显著增加,与C组及D组相比,A组BALF中HEo%增加特别明显(P<0.01)。而经地塞米松处理后BALF中Eos总数及HEo%明显下降(P<0.01),但仍高于C组(P<0.01)。
表1 BALF中不同密度Eos计数(1×108/L)及百分比(%)
tab 1 Count(1×108/L) and percentage (%) of Eos with different density in BALF
| Group |
n |
Ⅰ |
Ⅱ |
Ⅲ |
| Number |
% |
Number |
% |
Number |
% |
| C |
7 |
0.031±0.010 |
6.5±2.2 |
0.105±0.042 |
21.4±6.7 |
0.361±0.123 |
72.1±6.9 |
| A |
8 |
1.880±0.331** |
30.8±4.8** |
1.217±0.299** |
19.8±3.9 |
3.015±0.445** |
49.5±7.1** |
| D |
8 |
0.083±0.011▲ |
7.2±1.2▲ |
0.352±0.046▲ |
30.7±5.0*▲ |
0.721±0.128**▲ |
62.1±6.1**▲ |
Ⅰ:d≤1.080;Ⅱ:1.080<d≤1.090;Ⅲ:d>1.090;**:P<0.01 vs C;▲:P<0.01 vs A
2.2 实验动物肺组织IL-5 mRNA的表达水平
实验动物肺组织IL-5原位杂交结果镜下显示,哮喘时肺组织见较广泛阳性染色细胞,主要分布于气管粘膜下、肺泡间、甚至肺泡腔内。高倍镜下见阳性染色IL-5 mRNA定位于胞浆,呈紫蓝色,见图1。而D组与C组实验动物肺组织可见少许阳性染色细胞,见图2,3。表2示图像分析结果,A组肺组织IL-5 mRNA水平明显高于C组及D组(P<0.01),而D组IL-5 mRNA水平与C组相比差异不明显(P>0.05)。
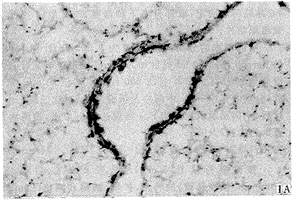
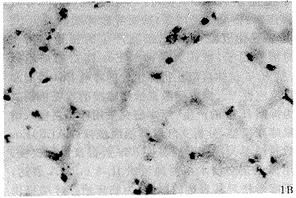
图1 哮喘豚鼠肺组织IL-5 mRNA表达 A:ISH×100;B:ISH×400
Fig 1 IL-5 mRNA expression in lung tissue of asthmatic guinea pigs A:ISH×100;B:ISH×400
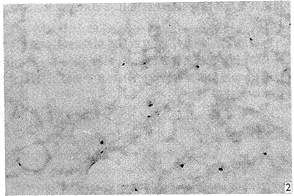
图2 正常豚鼠肺组织IL-5 mRNA表达 (ISH×100)
Fig 2 IL-5 mRNA expression in lung tissue of normal guinea pigs (ISH×100)

图3 地塞米松治疗组豚鼠肺组织IL-5 mRNA表达 (ISH×100)
Fig 3 IL-5 mRNA expression in lung tissue of dexamethasone-treated guinea pigs (ISH×100)
表2 肺组织IL-5 mRNA的表达水平(面密度10-3)
tab 2 IL-5 mRNA expression in lung tissue(10-3)
| Group |
n |
IL-5 mRNA |
| C |
7 |
7.86±2.48 |
| A |
8 |
27.18±13.8** |
| D |
8 |
8.73±3.98▲ |
**:P<0.01 vs C; ▲:P<0.01 vs A2.3 肺组织IL-5 mRNA表达水平与Eos有关参数的相关分析
相关分析表明,IL-5 mRNA水平与Eos总数及HEo%非常显著正相关(r分别为0.688、0.582)。
3 讨论
3.1 IL-5 mRNA表达与哮喘嗜酸性粒细胞增多的关系
本实验以原位杂交技术证实哮喘豚鼠肺组织IL-5 mRNA表达水平增高。已知IL-5为Eos分化、发育及功能调节的重要分子,IL-5过度表达与Eos增多相关[8]。在体外NEo与IL-5共育后变为HEo,并可自发地分泌其中的多种碱性蛋白。在本实验中,致敏豚鼠以OA诱发哮喘24 h后收集BALF,可见BALF中Eos总数及HEo均较正常组显著升高,表明哮喘时活化的Eos增多。哮喘豚鼠Eos特别是HEo升高,与肺组织IL-5 mRNA水平增加密切相关。IL-5可能通过直接、间接趋化、粘附作用募集Eos到达肺组织局部。肺组织局部高浓度IL-5进一步活化Eos,促进炎性介质释放而造成损伤效应及气道高反应性[9]。
3.2 地塞米松对哮喘豚鼠肺组织IL-5 mRNA及Eos浸润的影响
由于本实验D组是在OA激发前6 d对致敏动物持续给予地塞米松,地塞米松在体内的作用持续较久,对IL-5 mRNA的表达抑制作用较强,因此当以OA激发后实验动物肺组织IL-5 mRNA水平显著受抑,并与哮喘症状减轻相一致。Eos为哮喘主要炎症浸润细胞及效应细胞,D组肺组织不同密度Eos均较A组下降,特别是地塞米松处理后d≤1.080的HEo%下降最为明显,几乎降至C组水平。图像分析表明D组肺组织IL-5 mRNA水平较A组显著降低,与C组相比无统计学差别。表明地塞米松对IL-5 mRNA表达的抑制作用极为明显。已知Eos不同密度代表细胞处于不同功能活化状态,d≤1.080的HEo更可能为一种过活化状态。在本研究中,我们定义比重小于1.090的Eos为HEo。相关分析表明,IL-5 mRNA水平与HEo%正相关,推测地塞米松通过下调IL-5而抑制Eos。其机制可能在于肺组织局部IL-5水平下降,使外周血Eos在组织局部的聚集减少[10],因此表现为D组BALF中Eos总数下降;另一原因可能在于通过抑制IL-5,减轻IL-5对Eos的活化作用,这主要表现在D组较A组HEo%的明显降低。
作者简介:毕玉田,田,32岁,主治医师,讲师,硕士作者单位:毕玉田 杨肇亨 第三军医大学附属大坪医院呼吸内科 重庆,400042
王长征 附属新桥医院呼吸内科研究所 重庆,400037
参考文献
1 中华医学会呼吸系病学分会.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗、疗效判断标准及教育和管理方案).中华结核和呼吸杂志,1997,20(5):261
2 Wardlaw A. The eosinophil:new insights into its function in human health and disease. J Pathol,1996,179(4):355
3 Yamaguchi Y, Suda T, Tominaga K, et al. Analysis of the survival of mature human eosinophils: interleukin-5 prevents apoptosis in mature human eosinophils. Blood,1991,78(10):2542
4 Akustu I, Kojima T, Kariyone A, et al. Antibody against interleukin-5 prevents antigen-induced eosinophil infiltration and bronchial hyperreactivity in the guinea pig airways. Immunol Lett,1995,45(1-2):109
5 Bentley A M, Hamid Q, Robinson D S, et al. Prednisolone treatment in asthma: reduction in the numbers of eosinophils, T cells, tryptase-only positive mast cells, and modulation of IL-4,IL-5, and interferon-gamma cytokine gene expression within the bronchial mucosa. Am J Respir Crit Care Med,1996,153(2):551
6 Hutson P A, Church M K, Clay T P, et al. Early and late-phase bronchoconstriction after allergen challenge of nonanesthetized guinea pigs. I. The association of disordered airway physiology to leukocyte infiltration. Am Rev Respir Dis,1988,137(3):548
7 蔡文琴,王伯 主编.实用免疫细胞化学与核酸分子杂交技术.成都:四川省科学技术出版社,1994.406~434
8 Sur S, Gleich G J, Swanson M D, et al. Eosinophilic inflammation is associated with elevation of interleukin-5 in the airways of patients with spontaneous symptomatic asthma. J Allergy Clin Immunol,1995,96(5pt1):661
9 Foster P, Hogan S P, Young I G, et al. Interleukin 5 deficiency abolishes eosinophilia, airways hyperreactivity, and lung damage in a mouse asthma model. J Exp Med,1996,183(1):195
10 W G M,Hartnell A, Wardlaw A J, et al. IL-5 enhances the in vitro adhesion of human eosinophils, but not neutrophils,in a leukocyte integrin (CD11/CD18)-dependent manner. Immunology,1990,71(2):258