第二章 免疫球蛋白
免疫球蛋白(immunoglobulin,Ig)通常是指一组具有抗体活性和(或)抗体样结构的球蛋白。Ig由浆细胞产生,存在于血液和其他体液(包括组织液和外分泌液)中,约占血浆蛋白总量的20%;还可分布在B细胞表面。Ig的结构具有不均一性,可分为不同的类型;多数Ig具有抗体活性,可以特异性识别和结合抗原,并引发一系列生物学效应。
第一节 免疫球蛋白的化学
免疫球蛋白具有蛋白质的通性,能被多种蛋白水解酶裂解;可以在乙醇、三氯醋酸或中性盐类中沉淀,常用50%饱和硫酸铵或硫酸钠从免疫血清中提取抗体球蛋白。血清电泳时免疫球蛋白主要分布于γ区,因而以往曾称抗体为γ球蛋白。其实具抗体活性的球蛋白除存在于γ区外,也可延伸到β区,甚至α2区,这反映了抗体由不同细胞克隆产生的不均一性和结构的多样性。自从发现骨髓瘤患者尿中的本周蛋白是Ig的轻链以后,对其氨基酸顺序的研究大大促进了对Ig化学性质的了解。
(一)Ig的基本结构
Ig分子由4条肽链组成,2条长链称为重链(heavychain,H),由大约440个氨基酸残基组成,分子量约50~70kD;2条短链称为轻链(lightchain,L),由大约220个氨基酸组成,分子量约22.5kD。4条肽链通过链间二硫键(-S·S-)连在一起。其结构模式见图2-1。
Ig分子肽链的N端,在L链1/2和H链1/4处(约在110位前)氨基酸的种类和顺序各不相同,称为可变区(variableregion,V区);肽链C端其余部分的氨基酸,在种类和顺序上彼此间差别不大,称为稳定区或恒定区(constantregion,C区)。
V区位于N端,H链和L链各有3个高变区(hypervariableregion),其中的氨基酸残基种类和顺序特别多变。这此都与识别抗原直接有关,为Ig分子的抗原结合部位,故亦称为互补决定区(complementaritydeterminingregion,CDR)。
可变区中的其他氨基酸残基称为构架区(frameworkregion,FR),大约占整个V区近75%,其顺序很少变化(约5%)。FR的功能为支持CDR,并维持V区三维结构的稳定性。H和L链的FR在某些位置上具有相同的氨基酸残基。根据VH/VL氨基酸顺序同源程度的差异,可将Ig分为群和亚群。
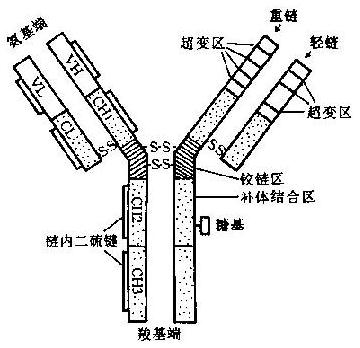
图2-1免疫球蛋白(IgG)结构模式图
(二)Ig的三维结构
Ig分子的每一条肽链,都由链内二硫键将相邻的二级结构单元折叠成球形局部性区域(图2-2);每个球形区约由110个氨基酸残基组成,不同Ig分子对应球形区的氨基酸残基顺序具有高度的相似性,因此称为同源区(domain)。IgG、IgA和IgD分子共有12个同源区,其中Lκ或Lλ各2个:VL和CL;H链各4个:VH、CH1、CH2和CH3。IgM和IgE分子各有14个同源区,因为其H链上多一个CH4。虽然H链和C区的不同区域彼此同源,并且与L链的CL同源,但它们与V区的氨基酸排列顺序极少相同,说明V区和C区是由不同的基因(V基因和C基因)分别编码的。每个同源区担负着一定的免疫功能,因而也称为功能区(fumctionalregion)。可变区中的氨基酸排列顺序呈高度变异性,其高变区对应的VL和VH形成袋状,随氨基酸残基的不同形状各异,以能与多种多样的抗原决定簇相适应,构成抗体特异性的分子基础。同时CH和CL区的氨基酸排列顺序相对稳定,又适应其发挥许多特定的生物学效应,如固定补体和调节Ig分解代谢率等功能位于CH2,而亲和细胞的功能则在CH3或CH4。
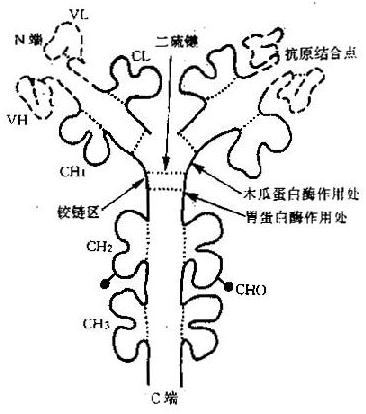
图2-2免疫球蛋白(IgG)的功能区示意图
在重链CH1和CH2之间的区域富含脯氨酸和半胱氨酸和半胱氨酸,这两类氨基酸的游离基团少,几乎不与邻近的区域形成固定的二级或三级结构。这一自由柔曲的肽段称为铰链区(hingeregion)。该区结构的柔韧性允许抗体分子的抗原结合部位随意改变方向,使抗体分子结合抗原的能力大大增强。同时也因Ig变构而使补体结合点暴露出来。
(三)Ig的水解片段
Ig分子可被许多蛋白酶水解,产生不同的片段;免疫学研究中常用的酶是木瓜蛋白酶(papain)和胃蛋白酶(pepsin)。
木瓜蛋白酶在生理pH下将IgG分子从H链二硫键N端219位置上断裂,生成两个相同的Fab片段和一个Fc片段(图2-3)。Fab段即抗原结合片段(antigenbindingfragment),含1条完整的L链和H链的一部分(Fd)段,分子量为45kD;Fab段仍具有抗原结合活性,但结合能力较弱,只有一价。Fc段即可结晶片段(crystallizablefragment),为2条H链C端剩余的部分,分子量55Kd,在一定条件下可形成结晶。Fc段不能与抗原结合,但具有许多其他生物学活性,如固定补体、亲和细胞(巨噬细胞、NK细胞和粒细胞等)、通过胎盘、介导与细菌蛋白(如蛋白A和G)的结合,以及与类风湿因子反应等。
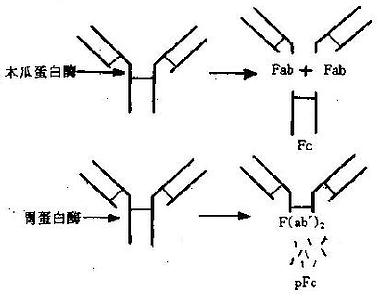
图2-3IgG分子的水解片段模式图
胃蛋白酶于于低pH下可将IgG分子从H链间二硫键C端232位置切断,形成含2个Fab段的F(ab')2片段和1个较小的pFc'片段。F(ab')2段即双价抗体活性片段,经还原后可得2个Fab'。Fab'的分子量略大于Fab,而生物活性与Fab相同。pFc'比Fc分子量小,虽然仍保持亲和巨噬细胞及与某些类风湿因子结合的能力,但失Fc片段原有的固定补体等活性。
(四)Ig的辅助成分
1.连接链除了H链和L链外,多聚体形式的Ig分子如IgA和IgM尚含1分子连接链(joiningchain,J链);但单体IgA或IgM单体均无J链。J链在连接单体形成多聚体Ig分子中并非必要,但可能与保持已形成的多聚体的稳定性有关。人类J链的分子量约15kD,与其他物种的J链有高度同源性。J链基因并不是Ig基因簇的一部分,它定位于15号染色体。J链有仅产生于合成IgA和IgM的浆细胞,而且也产生于合成IgG的未成熟浆细胞,但它并不与IgG分子结合。
2.分泌片在分泌型IgA分子中还含有1个分泌成分(secretorycomponent,SC),或称分泌片(secretorypiece,SP),是上皮细胞上的多免疫球蛋白受体(polyimmunoglobulinreceptor,poly-IgR)的一部分,Poly-IgR为免疫球蛋白超族)Igsuper-family)的一个成员。此受体由上皮细胞产生后,与多聚体IgA牢固结合;IgA-poly-IgR复合物由上皮细胞内输出的过程中,受体分子被蛋白酶裂解,仍附着于Ig的剩余部分即为分泌片。游离分泌片的分子量为80Kd,借二硫键与SigA共价结合。分泌片的功能是保护SigA分子不被分泌液片内的蛋白酶降解,从而使SigA在粘膜表面保持稳定和有利于其发挥生物活性。