第三节 LDL受体相关蛋白
LDL受体相关蛋白质(LDL receptor related protein ,LRP)是Herz等于1988年发现,其组成及结构与LDL受体类同,可能属于残粒受体(remnant receptor)的一种。其后证明,LRP又是α2-巨球蛋白(α2-macroglobulin,α2MG)受体。根据LRP的cDNA分析,他含有与LDL受体相同重复序列,而且与LDL受体重复序列互补的寡核苷酸可与LRP交叉杂交,所以称为LDL受体相关蛋白。LRP组成及结构见图7-4所示。
一、LRP组成及合成部位
利用寡核苷酸筛查法,已得到LRp cDNA并已阐明LRP氨基酸排列顺序,如图7-6所示。LRP由4526个氨基酸残基组成,是一种大分子量的糖蛋白,分布于大多数细胞内膜。
LRP与LDL受体,二者的配体结合结构极为相似,并与补体C8/C9结构组成具有高度类同性。
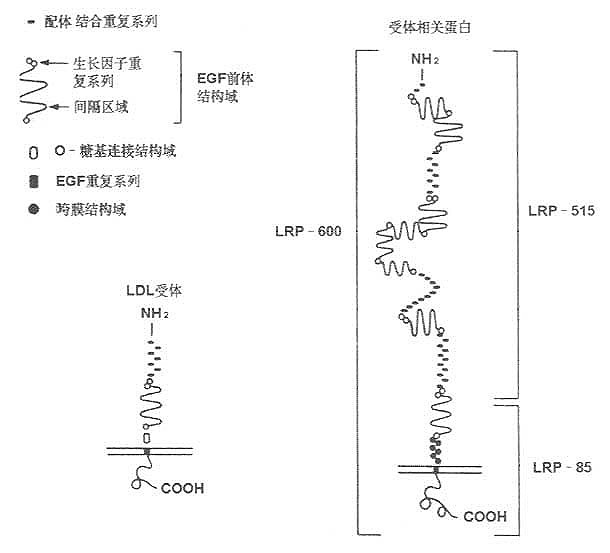
图7-4 LRP的结构与LDL受体结构比较
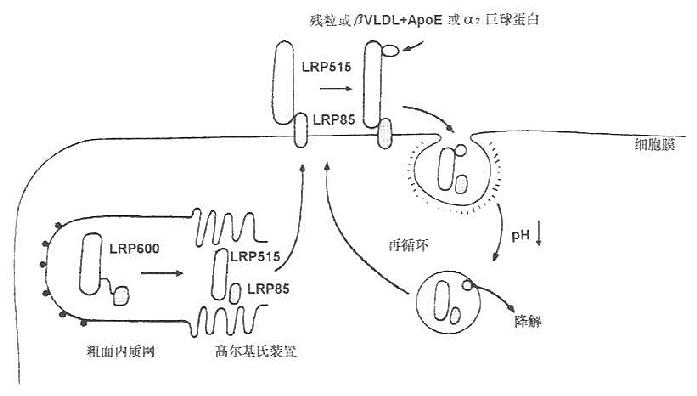
图7-5 LDL受体蛋白(LRP)的结构与代谢

图7-6 LRP的氨基酸序列
(引自Herz J.1988)
细胞膜外存在的ECG前体结构域,LRP与LDL受体也类同,其中细胞外部的结构同样以三种形式存在:①20个氨基酸中有6个半胱氨酸残基,这种A基元(A motif)带负电荷,该结构与脂蛋白结合有关;②EGF前体结构域的B基元的40个氨基酸中也有6个半胱氨酸存在,起有间隔基元的作用;③EGF前体结构域的另50个氨基酸序列中有Tyr-Trp-Thr-Asp结构,即YWTD重复序列。这一系列的相同性可能与这两种基因结构类似性有关。
LRP有两个疏水性很强的结构存在,其一是N端19个氨基酸的信号肽;其二是C端侧的组抽酸残基。跨膜结构域N端存在多个半胱氨酸,在细胞膜外侧以-S-S-键连接。LRP比LDL受体大两倍。LDL受体的有被小窝(coated pit)的第807位为酪氨酸,其周围的氨基酸组成与LRP高度相似。经有被小窝包吞作用(endocytosis)摄取细胞外物质的过程,LRP与其完全相同。在LDL受体胞液结构域的氨基酸序列中天冬酰胺-脯氨酸-X-酪氨酸(NPXY)重复序列存在,在LRP结构中也存在。
LRP在细胞粗面内质网合成,分子量为600kD(SDS-PAGE检测),在高尔基氏体内分解成515kD和85kD两种分子形式,分别称为α、β亚基,二者以非共价键结合。515kD的α亚基以贯通形式存在于细胞膜上,85kD的β亚基存在于膜内(见图7-5)。
二、LRP功能
直到目前为止,LRP的功能尚未完全清楚。LRP具有脂蛋白受体的以下特性:①摄取含ApoE的β-VLDL,摄取量与脂蛋白中ApoE含量有关;②ApoE存在时,LRP作用可促进脂蛋白的摄取;③LRP机能不受细胞内胆固醇水平的调节;④抑制含ApoC群的脂蛋白摄取,从而阻碍脂蛋白摄取。细胞内胆固醇含量不受下调作用的影响,是动脉粥样硬化灶中泡沫细胞生成的重要条件。LRP是信赖于Ca++的蛋白质,与配体结合需要Ca++的存在。
有报道,LRP可结合含ApoE的脂蛋白,并协同LPL的催化作用。LDL受体缺乏者,LRP起有重要作用。Kowdl和Beisiegel等报道,乳糜微粒残粒和β-VLDL均可被LRP识别;β-VLDL既可与LDL受体结合,又可与LRP结合;α2M也可作为配体与LRP结合,β-VLDL可抑制对α2M的摄取,以促进细胞内胆固醇酯的形成。α2M可与丝氨酸蛋白酶等多种蛋白质分解酶结合成复合物,并可经巨噬细胞膜上的α2M受体识别而进入细胞内,LRP则可抑制这种结合作用。LRP还可以抑制α2M与TGF-β、b-FGF、IL-Iβ和IL-b等细胞因子的结合作用。据此推测。分子结构与α2M受体蛋白为同一物质。利用精制的鼠肝细胞膜部分实验观察到,利用LDL受体缺乏的成纤维细胞实验,β-VLDL可竞争性抑制对α2M的摄取,α2M又可抑制乳糜微粒残粒的摄取。实验表明,LRP可能既是乳糜粒残粒受体,又是α2M受体之一。
经单克隆抗体免疫学实验检测,LRP蛋白质的mRNA在肝脏、肺、脑、小肠和肌肉等组织存在,与LDL受体比较,肝脏的LRp mRNA的量约有10倍之多。通过聚合酶链反应(PCR)和免疫组织化学检查发现,在动脉粥样硬化巢病变组织里,LRP含量迅速增加,并发现内膜的粥样硬化巢里由平滑肌细胞、巨噬细胞转变的泡沫化细胞中同样也有LRP的存在。