第五章 配位化合物
配位化合物简称配合物,又称络合物,是一类非常广泛和重要的化合物。随着科学技术的发展,它在科学研究和生产实践中显示出越来越重要的意义,配合物不仅在化学领域里得到广泛的应用,并且对生命现象也具有重要的意义。例如,在植物生长中起光合作用的叶绿素,是一种含镁的配合物;人和动物血液中起着输送氧作用的血红素,是一种含有亚铁的配合物;维生素B12是一种含钴的配合物;人体内各种酶(生物催化剂)的分子几乎都含有以配合状态存在的金属元素。因此学习有关配合物的基本知识,对学习医学来说也是十分必要的。
第一节 配合物的基本概念
一、配合物的定义
如果在硫酸铜溶液中加入氨水,首先可得到浅蓝色碱式硫酸铜[Cu(OH)2]SO4沉淀,继续加入氨水,则沉淀溶解而得到深蓝色溶液。显然由于加入过量的氨水,NH3分子与Cu2+离子间已发生了某种反应。
经研究确定,在上述溶液中生成了深蓝色的复杂离子[Cu(NH3)4]2+。从溶液中还可结晶出深蓝色[[Cu(NH3)4]SO4晶体。这说明CuSO4溶液与过量氨水发生了下列反应:

或离子方程式
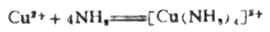
已知NaCN,KCN有剧毒,但是亚铁氰化钾(K4 [Fe(CN)6])和铁氰化钾(K3[Fe(CN)6])虽然都含有氰根,却没有毒性,这是因为亚铁离子或铁离子与氰根离子结合成牢固的复杂离子,失去了原有的性质。
[Fe(CN)6])和铁氰化钾(K3[Fe(CN)6])虽然都含有氰根,却没有毒性,这是因为亚铁离子或铁离子与氰根离子结合成牢固的复杂离子,失去了原有的性质。
由一个阳离子(如Cu2+或Fe3+)和几个中性分子(如NH3)或阴离子(如CN-)以配价键结合而成的,具有一定特性的复杂粒子,其带有电荷的叫配离子或络离子,其不带电荷的叫配合分子或络合分子。配合分子或含有配离子的化合物叫配合物。例如:[Cu(NH3)4]SO4,K4[Fe(CN)6],K3[Fe(CN)6],K2[HgI4],[Ag(NH3)2]NO3,[Pt(NH3)2CL4],[Co(NH3)5(H2O)]CL3等都是配合物。
二、配合物的组成
(一)中心离子
中心离子也称配合物的形成体,它是配合物的核心部分,位于配离子(或分子)的中心,一般都是带正电荷的,具有空的价电子轨道的阳离子。例如,上例中的Cu2+,Fe3+,Pt4+等。中心离子绝大数都是金属离子。其中的过渡金属离子是较强的配合物形成体。
(二)配位体
在配离子中同中心离子配合的离子(或分子)叫配位体。配位体是含有孤对电子的分子或阴离子,直接同中心离子结合的原子称为配位原子。配位原子主要属于周期表中Ⅴ、Ⅵ、Ⅶ三个主族元素。一个配位体可能含有一个以上的配位原子。
配合物一般可分为内界和外界两个组成部分。中心离子和配位体组成配合物的内界,在配合物的化学式中一般用方括号表示内界,方括号以外的部分为外界。例如,在[Cu(NH3)4]SO4中,四个NH3和一个Cu2+组成内界,一个SO2-4为外界。在K3[Fe(CN)6]中,六个CN-和一个F3+组成内界,三个K+为外界。
在[Pt(NH3)CL4]中,二个NH3,四个CL-和Pt4+为内界,它没有外界。
配位体按所含配位原子的数目,可分为单齿配体和多齿配体。只有一个配位原子同中心离子配合的配位体,称为单齿(或一价)配体,如F-,CL-,Br-,I-,CN-,NO-2,NO-3,NH3,H2O等。有两个以上的配位原子同时跟一个中心离子配合的配位体,统称为多齿配体,如乙二胺H2N-CH2-CH2-NH2,有两个氨基氮是配位原子。又如,乙二胺四乙酸根(-OOC-CH2)2N-CH2-CH2-N(CH2-COO-)2中,除有两个氨基氮是配位原子外,还有四个羟基氧也是配位原子。
现将常见的配位体列入表5-1。
表5-1 常见的配位体
配位原子 |
配位体举例 |
卤素 |
F-,CL-,Br-,I- |
O |
H2O,RCOO-,C2O2-4(草酸根离子) |
N |
NH3,NO(亚硝基),NH2-CH2-CH2-NH2(乙二胺) |
C |
CN-(氰离子) |
S |
SCN-(硫氰根离子) |
(三)配位数
在内界里,与中心离子的结合的配位原子的数目,叫做该中心离子的配位数。一般中心离子的配位数为2,4,6,8。最常见的是4和6(表5-2)
表5-2 常见离子的配位数
配位数 |
离子 |
2 |
Ag+,Cu2+,Au+ |
4 |
Zn2+,Cu2+,Hg2+,Ni2+,Co2+,Pt2+,Pd2+,Si4+,Ba2+ |
6 |
Fe2+,Fe3+,Co2+,Co3+,Cr3+,Pt4+,Pd4+,Al3+,Si4+,Ca2+,Ir3+ |
8 |
Mo4+,W4+,Ca2+,Ba2+,Pb2+ |
配位数 |
离子 |
在计算中心离子的配位数时,一般是先在配合物中确定中心离子和配位体,接着找出配位原子的数目。如果配位体是单齿的,配位体的数目就是该中心离子的配位数。例如,[Pt(NH3)4]Cl2和[Pt(NH3)2Cl2]中的中心离子都是Pt2+,而配位体前者是NH3,后者是NH3和Cl--,这些配位体都是单齿的,因此它们的配位数都是4。
如果配位体是多齿的,那么配位体的数目显然不等于中心离子的配位数(见螯合物一节)。
(四)配离子(或络离子)的电荷
配离子的电荷等于中心离子电荷与配位体电荷的代数和。
[Cu(NH3)4]2++2+4×0=+2
[Fe(CN)6]3- +3+6×(-1)=-3
[Fe(CN)6]4- +2+6×(-1)=-4
[HgI4]2- +2+4×(-1)=-2
三、配合物的命名
配合物的命名方法从一般无机物的命名原则:阴离子名称在前,阳离子名称在后;当配离子是阳离子时,外界阴离子为酸根;当配离子是阴离子时,则该配离子为酸根。命名时,酸根为简单离子时称“某化某”,酸根为复杂离子时称“某酸某”。在命名配离子时,要在形成体与配位体的名称间加个“合”字,并按下列顺序列出其组成部分的名称。配位体数-配位体名称-“合”字-形成体名称-形成体价态(用罗马数字表示)。当配位体个数为一时,有时可将“一”字省去。若形成体仅有一种价态时也可不加注罗马数字。如果内界中含有不止一种配位体,则命名时,阴离子配位体在先,中性分子配位体在后。对于几种不同阴离子组成的配位体,命名顺序为:简单阴离子-复杂阴离子-有机酸根离子。对于几种中性分子组成的配位体,命名顺序为:简单阴离子-复杂阴离子-有机酸根离子。对于几种中性分子组成的配位体,命名顺序为:水-氨-有机分子。
配位体的个数用一、二、三等表示。
中心离子的价态用Ⅰ、Ⅱ、Ⅲ等表示。
例如:
[Cu(NH3)4]2+四氨合铜(Ⅱ)离子
[Fe(CN)6]3- 六氰合铁(Ⅲ)离子
配离子是阳离子的配合物:
[Co(NH3)4CL2]CL氯化二氯四氨合钴(Ⅲ)
[Cu(NH3)4]SO4硫酸四氨合铜(Ⅱ)
配离子是阴离子的配合物:
K2[PtCL6]六氯合铂(Ⅳ)酸钾
Na4[Fe(CN)6] 六氰合铁(Ⅱ)酸钠
在不致引起误解的情况下,“合”字和价数有时可以省略。如二氯二氨合铁(Ⅱ)可称为二氯二氨铂,称为氯化二氨银。
有些常见的配合物和配离子可用简称。
K4[Fe(CN)6] 亚铁氰化钾
K3[Fe(CN)6] 铁氰化钾
K2[PtCL6] 氯铂酸钾
K2[HgI4]碘化汞钾
[Ag(银NH3)2]+ 氨配离子
[PtCL6]2- 氯铂酸根